г. Харьков, ул. Алексеевская, 14
(057) 773-26-59, (066) 437-95-62
⏰ с 9:00 до 21:00
Посмотреть контакты
г. Харьков, Салтовское шоссе, 262/1
(063) 189-96-05, (066) 037-12-84
⏰ Круглосуточно
Посмотреть контакты
г. Харьков, ул. Холодногорская, 10
(073) 451-43-56, (095) 550-68-25
⏰ Временно закрыта
Посмотреть контакты
Опыт лечния бабезиоза собак с применением современных технологий
- Информация о материале
- Просмотров: 188
В. А. Клубань
Харьковский ветеринарный госпиталь г. Харьков
Бабезиоз собак – протозойная неконтагиозная трансмиссивная болезнь, вызывающая инвазию и разрушение эритроцитов простейшим паразитом рода Babesia. Болезнь протекает остро, подостро, хронически. Проявляется заболевание повышенной температурой, анемией, гемоглобинурией, поражением ЦНС.
- Общие описание и история патологии
- Клиническая картина заболевания
- Диагностика
- Лечение (описание истории болезни конкретного пациента), опыт использования в лечении бабезиоза процедуры мембранного плазмафереза в тяжелых случаях течения заболевания
- Исход болезни и выводы
- Список использованной литературы
1
Бабезиоз собак – протозойная неконтагиозная трансмиссивная болезнь, вызывающая инвазию и разрушение эритроцитов простейшим паразитом рода Babesia. Болезнь протекает остро, подостро, хронически. Проявляется заболевание повышенной температурой, анемией, гемоглобинурией, поражением ЦНС.
Lounsbury (1902) стало известно от некоторых старых исследователей в провинции «Cape», что о билиарной лихорадке собак знали ещё в середине XIX века в Южной Африке. Он предполагал также, что заболевание собак, описанное Lady Anne Barnard в письме, датированном 29 ноября 1779 года, было не иначе как бабезиоз собак . В 1895 году Piana и Galli Walerio сообщили, что заболевание, известное как желчная лихорадка или злокачественная желтуха охотничьих собак в Ломбардии (Италия), было обусловлено кровопаразитом, которому они дали название: bigeminum (вариант canis). Этот паразит позднее был определён как Pyroplasma canis, ещё позже - Babesia canis . Название Pyrosoma возбудитель получил по характерному грушевидному виду (pirum - груша).
Hutcheon (1896) считал заболевание самостоятельным, хотя первоначально болезнь рассматривалась как билиарная форма (biliary form) чумы собак . R.Koch в 1898 году наблюдал у собак в восточно-германской Африке (Dar-es-Salam) маляриеподобное заболевание и обнаружил при этом паразитов, более или менее сходных с паразитами малярии человека. В 1899 году Hutcheon описал подобное заболевание в Южной Африке . Spreul (1899), заразил восприимчивых собак небольшой дозой крови, взятой от больной собаки, таким образом он установил трансмиссивный путь заражения, а также то, что при внутривенном пути введение болезнь протекает гораздо тяжелее, чем при подкожном. Микроскопическое исследование проводил Purvis (Hutcheon, 1896) обнаруживший внутриэритроцитарных паразитов. Robertson (1901), подтвердил наблюдения Purvis и Spreul, констатируя, что внутриэритроцитарные паразиты наблюдались в каждом случае заболевания на четвёртый день после подкожного заражения, а кровь становится инвазированной на третий день.
Другой возбудитель бабезиоза собак, Babesia gibsoni, был описан Pattonом в 1909 году у охотничьих собак в Мадрасе и у шакалов (Canis aureus), хотя ещё раньше заболевание наблюдали у собак и шакалов в Индии в 1910 году. Затем было доложено о заболевании у лис в Мали, у собак в Куала-Лумпуре, Малайзии, Египте . В.Л.Якимов в 1931 году относил возбудителя к роду Achromaticus, виду Achromaticus gibsoni Patton, 1910.
В России возбудитель Babesia canis был обнаружен в 1909 году В.Л.Якимовым в Петербурге у собаки, привезённой с Северного Кавказа, и В.Л.Любинецким, наблюдавшим возбудителя в Киеве, затем было сообщение от А.И.Джунковского и К.К.Луса о возбудителе в Закавказье. Кроме них, пироплазмоз в России исследовали: И.П.Оболдуев (1910), Дубицкий (1921), Орлов в Сибири (1926), Фролов в Казани, Виноградов в Саратове, Якимов, Арбузов и Самарцев в Уральске (1928, 1929) Белицер и Мирков (1929) . Якимов (1926), в связи с открытием новых форм пироплазм, поместил Babesia canis в подрод Piroplasma на том основании, что паразит имеет размеры больше радиуса эритроцита.
Заболевание широко распространено во всех регионах земного шара, но чаще в тропической зоне. В субтропиках и умеренном климате встречается реже (так было по данным на 1937г).
Переносчиком возбудителя является в Африке Haemaphysalis leachi, в Индии и Тунисе - Rhipicephalus sanguineus, во Франции – Dermacentor marginatus. В России переносчиком служит, по сообщениям Белицера и Маркова, клещ Dermacentor marginatus . Выводы А.А.Маркова о специфичности переносчика подтверждаются спустя 54 года данными G.Uilenberg et al., (1989) и S.Hauschild et al. (1995).
Laveran и Nattan-Larrier (1913); Regendanz и Reichenow (1932); Reichenow (1935); Brump (1938), докладывали, что вирулентность B.canis проявляется значительными вариациями в разных ареалах распространения. Так, штамм из одной зоны может вызвать быстрое развитие клинических признаков и смерть у восприимчивой собаки, в то время как штамм из другой зоны вызывает только относительно слабую реакцию, хотя паразиты морфологически схожи. Laveran и Nattan-Larrier (1913), обнаружили, что собаки, иммунизированные французским штаммом, восприимчивы к североамериканскому. Исходя из этого, они заключали, что оба штамма могли быть рассмотрены как различные виды или варианты B.canis. Reichenow 1935, полагал, что морфологически схожие виды крупных собачьих пироплазм в реальности являются отдельными видами. Он предположил это на основе того, что один из природных штаммов B.canis, который переносится клещом Rhipicephalus sanguineus, не может переноситься клещом Dermacentor marginatus. В то же время штамм, который переноситься D.marginatus, не может переноситься Rh.sanguineus. Reichenow отделил в 1935 году паразитов Rhipicephalus – transmitted как отдельный вид от Европейского штамма Dermacetor – transmitted. Он также утверждал, что первый штамм был незначительно крупнее в размере. Поэтому он дал ему название Babesia major, но так как это имя было использовано, то переименовал в Babesia vogeli. Это название было забыто и не употреблялось.Brump 1938, так же полагал штаммы пироплазмоза собак, имеют различия в антигенной структуре.
Исследования в 1989 году G.Uilenberg et all, подтвердили различия и специфичность переносчика (с помощью методов перекрёстного иммунитета и непрямой иммунофлюоресценции) между штаммами крупных собачьих бабезий, которые передаются трансмиссивно клещами родов Dermacentor, Rhipicephalus, Haemaphysalis. А также исследователи предложили номенклатурные названия подвидам B.canis: B.canis canis (Piano and Galli-Valerio, 1895), B.canis vogeli (Reichenow, 1937), B.canis rossi (Nuttall, 1910).
Carret et all (2000) также подтверждал существование трех подвидов B.canis: B.canis canis; B.canis vogeli; B.canis rossi . Переносчиком паразита B.canis rossi является Haemaphysalis leachi и вызывает смертельный исход у домашних собак даже при лечении; B.canis vogeli – переносчиком является Rhipicephalus sanguineus, заболевание клинически не выражено; B.canis canis - переносчиком является Dermacentor reticulates, заболевание имеет клинические проявления различной силы.
В Украине и в России до настоящего времени был известен лишь один возбудитель бабезиоза собак – B.canis.. Помимо B.canis, бабезиоз собак вызывают виды: B.gibsoni и B.vogeli . Поэтому нельзя исключать наличие смешанной инвазии B.canis и B.gibsoni. Именно этот возбудитель мы зарегистрировали в последнее время.

При окраске мазков крови по Романовскому-Гимза Babesia canis может иметь различную форму: грушевидную, овальную, округлую, амебовидную, но в основном находят парногрушевидную форму паразита . Все формы могут различно ассоциироваться в одном эритроците.
Зараженные эритроциты часто более крупные и более бледные, чем другие. В отличие от B.gibsoni, которая обладает большим полиморфизмом, более мелкими размерами и чаще находят единичными в эритроцитах. Паразит имеет размеры: 4…5мкм в длину (грушевидные и парногрушевидные формы) и 2…4 мкм в диаметре (округлая и амёбовидная форма) . В периферической крови чаще наблюдаются единичные паразиты, реже парные и ещё реже три и более паразитов в одном эритроците.
Внутриэритроцитарный паразит размножается бинарным делением только в красных клетках крови . Инкубационный период природного штамма для B.canis составляет 10…21 дней, а для B.gibsoni 2…4 недели . В.Л. Якимов более подробно исследовал величину паразитов: круглых одиночных форм диаметром 2,13…4,26 мкм, круглых парных 2,84…4,26 х 1,42…2,84 мкм, грушевидных одиночных 3,5…4,26 х 2,13…2,82 мкм, грушевидных парных 3,14…5,32 х 1,95…3,14 мкм (в среднем 4,12 х 2,73 мкм), овальных одиночных 2,82…4,26 х 2,13…2,82 мкм, овальных парных 2,13…2,43 х 1,42 …1,77 мкм (Якимов,1911, 1929).
2
Клиническая картина резко изменилась за последние 4 года . На данный момент мы уже не наблюдаем классического течения заболевания : Т около 40.0* , проявления токсической энцефалопатии, моча цвета темного пива, кал с оранжевым оттенком, полидипсия, сезонность заболевания, и т.д. Чаще всего мы можем наблюдать только один из симптомов, возможно несколько.
3
В нашей клинике диагностика стоит на первом месте. Ведь правильно поставленный диагноз – это половина победы над заболеванием . Используется классический подход в постановке диагноза:
- Подробный сбор анамнеза.
- Скрупулезный клинический осмотр.
- Лабораторные исследования.
Первый шаг в диагностике – это обнаружение возбудителя в мазках из капиллярной крови, окрашенных по Романовскому – Гимзе. При первичных отрицательных результатах назначаются повторные исследования.
Проведение клинического и биохимического анализов крови.
Типичными изменениями являются:
- снижение уровня гемоглобина, свидетельствующее о развитии гемолитической регенеративной анемии. Но следует отметить, что в тяжелых, запущенных случаях, когда лечение не оказывалось или проводилось не адекватно, у животных из-за развития сильного интоксикационного синдрома и генерализованного поражения костного мозга идет нарушение гемопоеза т.е. развивается нерегенеративная анемия, уровень гемоглобина резко снижен, гематокрит около 15-20%. В таких случаях животному необходимо проведение гемотрансфузии ( переливание свежей крови ), возможно неоднократно.
- ускоренная реакция оседания эритроцитов.
- выраженный лейкоцитоз со сдвигом влево и моноцитоз. При нерегенеративной анемии наблюдается лейкопения и тромбоцитопения в большей или меньшей степени, в зависимости от уровня выраженности интоксикации и поражения костного мозга.
- билирубинемия.
- повышение уровня трансаминаз, но при выраженной интоксикации уровень трансаминаз может снижаться до уровня нормы из-за поражения гепатоцитов.
- нарушение функции почек определяется повышением уровня креатинина.
- из-за выраженного интоксикационного синдрома может возникать нарушение функции поджелудочной железы.
Проведение клинического и биохимического анализов крови в динамике дает возможность адекватно проводить лечение и при необходимости корректировать назначения.
4
Интенсивность проводимых лечебных мероприятий зависит от тяжести состояния животного. Наиболее часто применяемая схема: дезинтоксикационная терапия, симптоматическая и патогенетическая терапия, специфическая терапия с применением препаратов группы имидокарба и диминазина. В более тяжелых случаях мы применяем: гемотрансфузию и процедура мембранного плазмафереза на аппрате «ГЕМОФЕНИКС».
Одним из наиболее интересных случаев можно привести собаку по кличке «ПИКАССО”.
Порода – чау – чау
Возраст – 7 лет и 6 мес.
Вес – 23,400 кг.
Окрас – рыжий
Дата поступления – 08.09.2010
Анамнез: со слов владелицы общие состояние животного ухудшилось 4 дня назад, наблюдалась Т - 40.5 . Животное угнетено, от еды отказывается. При пальпации живот болезненный , тоны сердца ритмичные , выражен систолический шум , дыхание жесткое , выраженные влажные бронхиальные хрипы над всей поверхностью легких. Цвет слизистой ротовой полости и кожи – иктеричный. Последний акт мочеиспускания наблюдался 2 дня назад. При пальпации мочевой пузырь не определяется. Проведено:
- анализ крови на бабезиоз (+);
- общий анализ крови и Б/Х анализ крови.
Лечение : симптоматическая терапия; дезинтаксикационная терапия, введены специфические противопаразитарные препараты – ИМИДОСАН 1.2 мл. П/К.
Перорально – энтеросгель 1 ч. Л. 3 раза в день.
1й день лечения (08.09.2010 )
ОАК:
- Гемоглобин – 94
- Эритроциты – 3,7
- Цветовой показатель – 0,76
- СОЭ – 47
- Лейкоциты – 3,9
- Эозинофилы – 1
- Нейтрофилы палочкоядерные - 3
- Нейтрофилы сегментоядерные - 71
- Моноциты – 3
- Лимфоциты – 23
Б/Х анализ крови:
- Общий белок – 61
- Сахар – 3,8
- Мочевина – 26,7
- Креатинин – 0,815
- Билирубин ( общ. ) – 21,9
- Билирубин ( прямой ) – 2,7
- АЛТ – 20,8 ( мм/л)
- АСТ – 24,6 ( мм/л)
- Амилаза – 50 (мм/л)
2й день лечения (09.09.2010)
Т – 38,7. Общее состояние животного немного улучшилось. Стала передвигаться, мочилась, был стул. Аппетит отсутствует, пила воду, но после этого наблюдалась рвота. Была проведена интенсивная терапия (инфузионная терапия), была проведена процедура мембранного плазмафереза с использованием фильтра “ПФМ 500” и как основной использовался плазмофильтр «РОСА», проведена плазмосорбция с реосорбционной колонкой (углеродный сорбент). Было выделено 1% плазмы от объёма массы тела , с возвратом сорбированной плазмы в кровеносное русло . Имидосан введен повторно 1\2 дозы ( 0,6 мл . )

Проведение процедуры мембранного плазмафереза данному пациенту.
|
Плазмофильтр ПФМ – 500 |
Плазмофильтр «РОСА» |
|
Гемосорбент углеродный СКН |
Гемосорбент «ОВОСОРБ» |
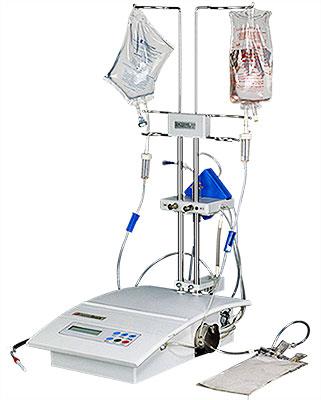
Аппарат для мембранного плазмафереза «ГЕМОФЕНИКС»
3й день лечения ( 10.09.2010)
Т – 37,5. Общее состояние животного остается тяжелым, но наблюдается слабая положительная динамика. Стала активнее, самостоятельно ходит, пьет воду, но наблюдается рвота послеприема воды. Так – как после получения результатов мы увидели стойкое повышение амилазы, креатинина и мочевины, было принято решение о применении биоспецифического протэиназного гемосорбента “ОВОСОРБ “ , через него пропустили 2.5 объёма циркулируемой крови .
4й день лечения (11.09.2010)
Т – 37,6. Общее состояние животного остается тяжелым. Угнетена, аппетит отсутствует, пьет воду. Наблюдается рвота слизьюс зеленым оттенком. Поноса нет. Цвет мочи желтый. Проведено:1. Контрольные ан. Крови: ОАК, Б/Х ан. Крови. 2. Дезинтоксикационная терапия. 3. Был проведен мембранный плазмаферез с эксфузией плазмы в объеме 300 мл.
ОАК:
- Гемоглобин – 130
- Эритроциты – 4,5
- Цветовой показатель – 0,92
- СОЭ – 56
- Лейкоциты – 13,8
- Эозинофилы – единичные
- Нейтрофилы палочкоядерные - 9
- Нейтрофилы палочкоядерные – 79
- Моноциты – 3
- Лимфоциты – 9
Б/Х ан. крови:
- Общ. Белок – 63
- Сахар – 5,8
- Мочевина – 23,7
- Креатинин – 0,890
- Билирубин общ. – 49,5
- Билирубин пр. – 39
- АЛТ – 18,4 е/л
- АСТ – 542,9
- РН крови – 7,329
- Na – 149
- К – 3,19
- Са* - 1,5
- Са** - 0,57
- Р – 3,7
- Амилаза – 61,7 мм/л
5й день лечения ( 12.09.2010 )
Т – 37,9. Общее состояние животного без изменений. Угнетена, аппетит отсутствует, рвота продолжается. Мочилась, стула нет. Проведено: 1. Был проведен мембранный плазмаферез с эксфузией плазмы в объеме 300 мл. 2. Дезинтоксикационная терапия. 3. Контрольные ан. Крови: ОАК, Б/Х ан. Крови.
ОАК:
- Гемоглобин – 63
- Эритроциты – 2,65
- Цветовой показатель – 0,7
- Гематокрит – 26%
- СОЭ – 79
- Лейкоциты – 10,6
- Нейтрофилы палочкоядерные – 7
- Нейтрофилы сегментоядерные – 78
- Моноциты – 2
- Лимфоциты – 13
Б/Х ан. крови:
- Общ. Белок – 52
- Сахар – 5,4
- Мочевина – 28,3
- Креатинин – 0,867
- Билирубин общ. – 30,9
- Билирубин пр. – 22,8
- АЛТ – 6,6 е/л
- АСТ – 301,4 е/л
- РН крови – 7,358
- Na – 150.2
- К – 2,71
- Са* - 1,7
- Са** - 0,63
- Р – 2,75
- Амилаза – 3335 е/л
6й день лечения (13.09.2010)
Т – 37,8. Общее состояние животного без изменений, крайне тяжелое. Угнетена, аппетит отсутствут, рвоты не было. Диурез адекватный, был стул.
Проведено: 1. Дезинтоксикационная терапия. 2. Контрольные ан. крови.
ОАК:
- Гемоглобин – 62
- Эритроциты – 2,5
- Цветовой показатель – 0,74
- СОЭ – 77
- Лейкоциты – 13,7
- Эозинофилы – 1
- Нейтрофилы палочкоядерные – не обнаружены
- Нейтрофилы сегментоядерные – 86
- Моноциты – 6
- Лимфоциты – 8
Б/Х ан.крови:
- Общ. Белок – 48
- Сахар – 5,2
- Мочевина – 28,8
- Креатинин – 0,980
- Билирубин общ. – 12,6
- Билирубин пр. – 2,3
- АЛТ – 5,9Е\Л
- АСТ – 337,5Е/Л
- Р – 3,03
- Амилаза – 63 мм/л
7й день лечения (14.09.2010)
Т – 37,8. Общее состояние животного стабильное, тяжелое. Клинически положительная динамика не наблюдается. Аппетит отсутствует, рвоты нет. Диурез адекватный. Проведены: 1. Дезинтоксикационная и симптоматическая терапия.
8й день лечения (15.09.2010)
Общее состояние животного со слов владелици немного улучшилось. Стала активнее, немного поела. Диурез адекватный. Цвет мочи св. желтый. Проведено: 1. ОАК, Б/Х ан. Крови. 2. Дезинтоксикационная терапия.
ОАК:
- Гемоглобин – 45
- Эритроциты – 2
- Цветовой показатель – 0,6
- СОЭ – 80
- Лейкоциты – 12,5
- Нейтрофилы палочкоядерные – 1
- Нейтрофилы сегментоядерные – 89
- Моноциты – 2
- Лимфоциты – 8
Б/Х ан. крови:
- Общ. Белок - 49
- Сахар – 4,1
- Мочевина – 29,7
- Креатинин – 0,867
- Билирубин общ. – 16,2
- Билирубин пр. – 12
- АЛТ – 0,5 е/л
- АСТ – 235,8 е/л
- Р – 2,75
- Са* - 1,75
- Амилаза – 60,2 мм/л
11й день лечения ( 18.09.2010)
Общее состояние животного стабильное, наблюдается положительная динамика. Стала немного активнее. Пила воду, кормление проводилось насильно. Рвоты нет. Проведены контрольные ан. крови: ОАК, Б/Х ан. крови.
ОАК:
- Гемоглобин – 42
- Эритроциты – 2
- Цветовой показатель – 0,63
- СОЭ – 52
- Лейкоциты – 10,6
- Эозинофилы – 1
- Нейтрофилы палочкоядерные – 16
- Нейтрофилы сегментоядерные – 66
- Моноциты – 5
- Лимфоциты – 12
Б/Х ан. крови:
- Общ. Белок – 65
- Сахар – 3,7
- Мочевина – 30,8
- Креатинин – 0,568
- АЛТ – 425,4
- АСТ – 305,7
- Р – 0,709
- Амилаза – 2800 е/л
Принято решение о проведении лечения в домашних условиях с применением энтеросорбентов, гепатопротекторов, фитотерапии. Наблюдалась устойчивая положительная динамика. Животное заметно активизировалось, аппетит в норме, стул и диурез в норме. Проводились контрольные анализы крови: ОАК, Б/Х анализ крови. Показатели трансаминаз пришли в норму, уровень креатинина остался в пределах 700-800 мкмоль/л.
5
В ходе проведения лечебной терапии использовались инфузионная терапия, форсированный диурез, мембранный плазмаферез , препараты улучшающие обменные процессы , витаминные комплексы , гепато – кардиопротекторы. Считаем, что применение комплексного лечения с использованием мембранного плазмафереза дает возможность стабилизировать общее состояние пациента и возможность животному выжить, даже в тяжелых случаях течения заболевания и в не молодом возрасте.
6
- Makimura S, Harasawa Р. 2001 года. Обнаружение видов Babesia в инфицированной крови собаки с помощью полимеразной цепной реакции. J Vet Med Sci 63:111-113.
- Birkenheuer A.J, Levi М., Savari K и др. 0,1999. Babesia gibsoni инфекции у собак из Северной Каролины. J Am Animal hospital 35:125-128.
- Comazzi S, S Paltrinieri 1999. Диагностика бабезиоза собак. J Vet Diag Invest 11:102-104.
- Gardiner CH, Файер R, Dubey JP. 1988 год. Атлас простейших паразитов в тканях животных. Министерство сельского хозяйства США, Справочник Сельское хозяйство № 651, п.п. 70-71.
- Тaboada J. 1998 года. Бабезиоз, инфекционныt болезней собак и кошек. WB Saunders, Philadelphia, PA, PP 473-481.
- Zaler М, Н Rinder, Zweygarth E, и др.. 2000 год. Babesia gibsoni собак из Северной Америки и Азии принадлежат к разным видам. Паразитология 120:365-369.
- Материалы статьи младшего научного сотрудника лаборатории протозоологии и арахнологии ВИЭВ Растрыгин А. Е. Бабезиоз собак (история открытия)
- Материалы сайта www.veterinar.ru








